
Audit-proof Digitization
Wirkungsvolle Digitalisierung als Grundlage für höhere Sicherheit bei FDA-Audits
Die steigende Zahl von Verstößen im Rahmen von FDA-Audits offenbart erhebliche Schwächen vieler Life-Sciences-Unternehmen bei der Kontrolle und Dokumentation ihrer Herstellungsprozesse. Um Compliance-Risiken effektiv zu minimieren, reicht es jedoch nicht aus, einzelne Symptome zu behandeln.
Vielmehr bedarf es einer wirkungsvollen Digitalisierung, die auf Standardisierung setzt, Medienbrüche überwindet und nachhaltig implementiert wird. Eine über alle Unternehmensbereiche und Regionen hinweg harmonisierte MES- bzw. LIMS-Landschaft bildet dabei eine wesentliche Grundlage für die zuverlässige Abbildung und Überwachung der Produktions- und Laborprozesse.
Die FDA hat im Fiskaljahr 2024 eine Rekordzahl an Warning Letters im Bereich Good Manufacturing Practice (GMP) ausgestellt. Laut dem aktuellen GMP-Journal wurden in diesem Jahr so viele Verstöße registriert wie seit zwanzig Jahren nicht mehr. Besonders betroffen sind demnach zentrale Bereiche der Produktion, Qualitätssicherung und Dokumentation.
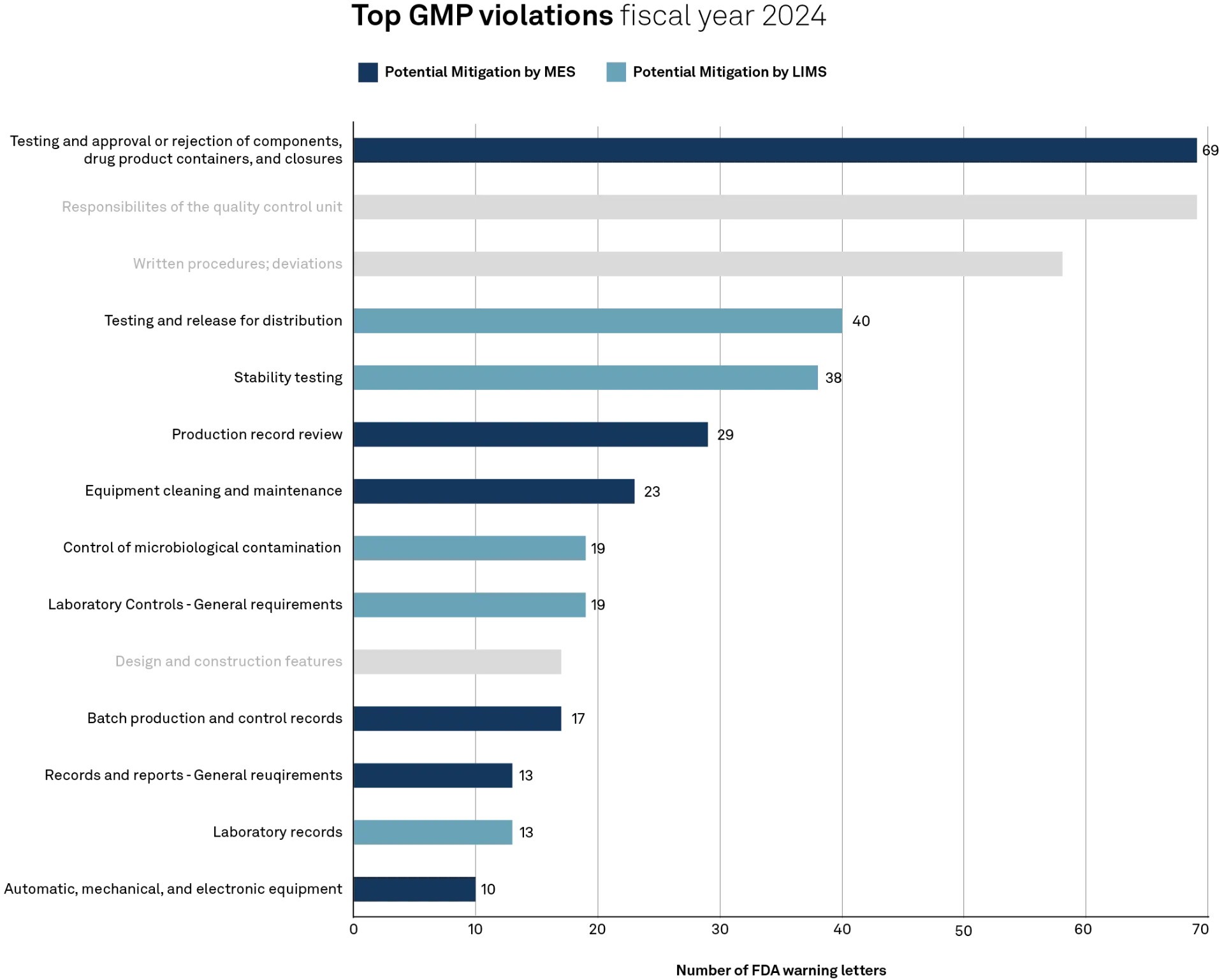
80% der Verstöße hätten durch ein MES oder LIMS mitigiert werden können
Ein Blick in die Daten zeigt: Die meisten Verstöße betreffen Prozesse zur Freigabe von Komponenten und Produkten (211.84), Verantwortlichkeiten in der Qualitätskontrolle (211.22) sowie Abweichungsmanagement und Dokumentation (211.100).
Weitere signifikante Beanstandungen gab es in den Bereichen Stabilitätstests (211.166) sowie Prüfung und Freigabe für den Vertrieb (211.165). Auch im Bereich der Laborpraxis wurden zahlreiche Mängel dokumentiert, insbesondere bei der Kontrolle mikrobiologischer Kontaminationen (211.113) und der Dokumentation von Labordatensätzen (211.194).
Punktuelle Problembehandlung reicht nicht aus
Die Analyse macht deutlich, dass viele dieser Verstöße auf unzureichende Dokumentationspraktiken und mangelnde Prozesskontrollen zurückzuführen sind. Hier zeigt sich ein scheinbarer Widerspruch: Wie ist es zu erklären, dass trotz eines zunehmenden Digitalisierungsgrades im Produktionsumfeld vieler Life-Sciences-Unternehmen die Zahl der Verstöße dennoch steigt?
Hier sind zwei wesentliche Faktoren zu berücksichtigen: Zum einen ist eine mangelhafte Dokumentation häufig nicht Ursache, sondern lediglich Symptom tieferliegender prozessualer Schwächen, wie etwa mangelnde Qualifizierung der Anlagen, unzureichende Wartung und nicht hinreichend definierte bzw. nicht konsequent umgesetzte Verfahrensanweisungen. Die reine digitale Abbildung der Dokumentation ist daher nicht automatisch ausreichend. Vielmehr müssen Digitalisierungsmaßnahmen mit klaren Prozessoptimierungen, Standards und Trainingsmaßnahmen verknüpft werden, um eine nachhaltige Compliance sicherzustellen und Abweichungen langfristig zu minimieren. Ansonsten bleibt die Wirkung digitaler Systeme begrenzt.
Zum anderen stehen viele der betroffenen Unternehmen erst am Anfang der digitalen Transformation oder kämpfen mit veralteten, heterogenen Systemlandschaften. Medienbrüche und mangelnde Integration gehen dabei weit über technische Probleme hinaus, sondern wirken sich unmittelbar auf die Prozesssicherheit und Compliance aus.
Wirkungsvolle Digitalisierung als Schlüssel für echte Prozesssicherheit
Der Weg zu nachhaltiger Compliance und der langfristigen Minimierung von Abweichungen führt über eine „wirkungsvolle“ Digitalisierung. Wirkungsvoll ist diese dann, wenn sie Produktions- und Laborprozesse durchgängig digital abbildet, auf standardisierten Prozessen über Standorte und Organisationseinheiten hinweg aufbaut und nachhaltig in der Organisation verankert ist.
Die Basis für eine wirkungsvolle Digitalisierung bilden in vielen Fällen Systeme wie ein zentrales Manufacturing Execution Systems (MES) bzw. Laboratory Information Management Systems (LIMS), die gezielte Möglichkeiten zur Risikominimierung entlang von GMP-Kernprozessen wie Chargenfreigabe, Abweichungsmanagement und Produktionsdatenerfassung bieten:
- MES als primäres Werkzeug zur robusten und effizienten Durchführung von Produktionsprozessen durch optimale Bedienerführung sowie zur Fehlervermeidung durch digitale Anlagenanbindung und Datenvalidierung in Echtzeit.
- LIMS ermöglicht eine durchgängige, standardisierte und regelkonforme Durchführung und Dokumentation von Laborprozessen. Die Implementierung unterstützt insbesondere die Einhaltung von Labor- und Compliance-Anforderungen.
Dabei gilt: Die Einführung von MES und LIMS ist kein reines IT-Projekt, sondern vielmehr ein umfassender Transformationsprozess, der alle betroffenen Bereiche – von der Qualitätssicherung bis zur Produktion – einbeziehen muss. Nur wenn Prozesse, Rollen und Verantwortlichkeiten klar und weltweit harmonisiert sind und die betroffenen Mitarbeitenden durch Schulungsmaßnahmen ausreichend befähigt werden, kann Digitalisierung ihre volle Wirkung entfalten.
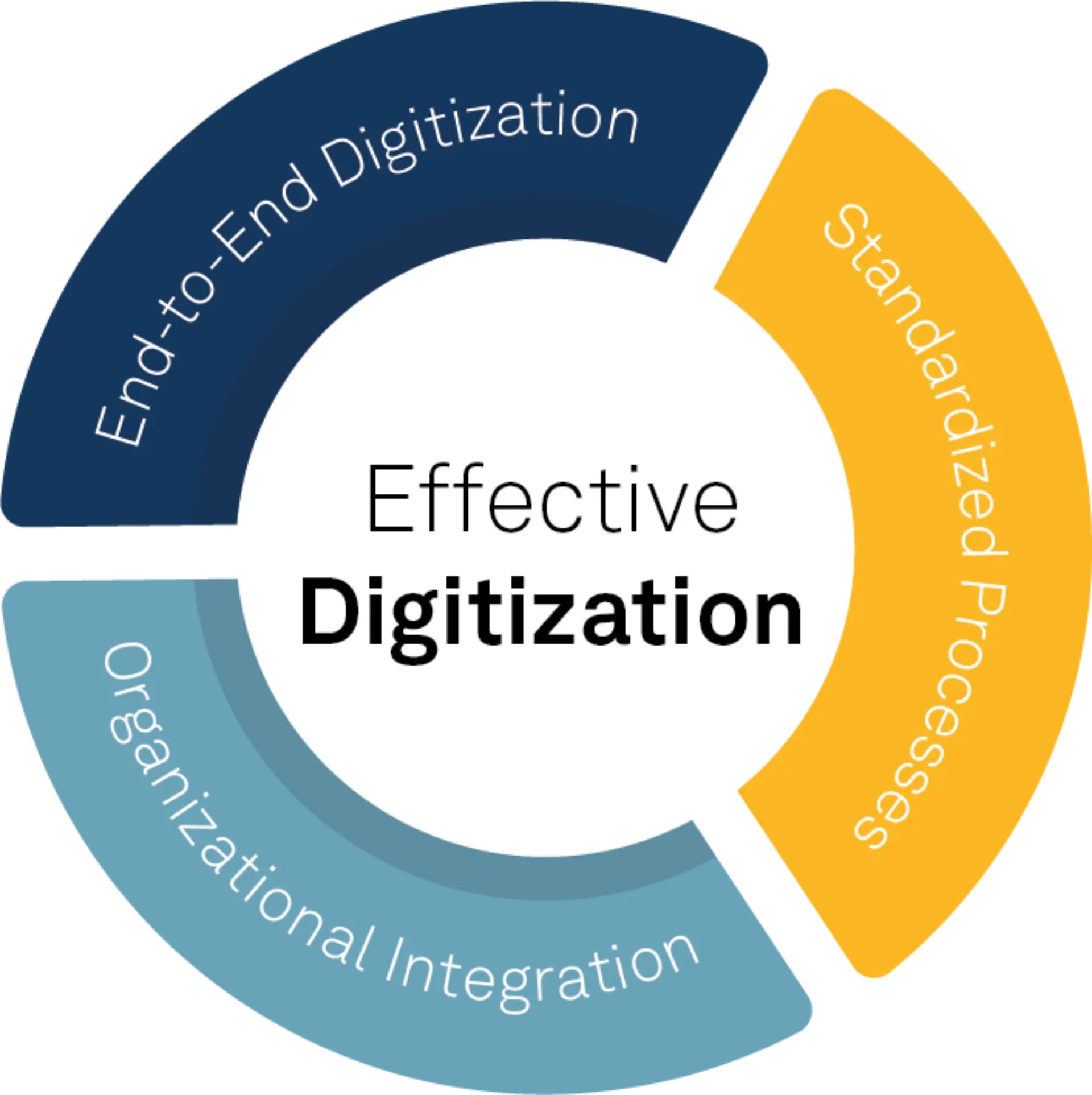
Drei zentrale Erfolgsfaktoren für wirkungsvolle Digitalisierung © msg industry advisors ag
Schneller Weg zur Compliance: strukturiert, fokussiert, wirksam
Was aber können Unternehmen angesichts der Rekordzahlen von FDA Warning Letters kurzfristig tun, um das Risiko von Verstößen wirksam zu reduzieren? Ein schneller und praktikabler Weg zu Compliance-konformen Prozessen beginnt mit einer initialen Schwachstellenanalyse (Gap Assessment), dem Einsatz bewährter Templates und SOPs sowie gezielten Schulungen in den besonders betroffenen Bereichen.
Ergänzt um ein stufenweises Rollout-Konzept für MES und LIMS – etwa in Form eines Minimum Viable Product (MVP) – lassen sich erste Erfolge rasch erzielen, ohne auf die langfristigen Vorteile einer vollständigen Systemintegration verzichten zu müssen. Entscheidend ist ein integrierter Ansatz aus Technologie, Prozessberatung und Change Management.
Auch eine professionelle Auditvorbereitung mit Mock-Inspections, Dokumentenreviews und gezielten Schulungen kann helfen, GxP-konforme Prozesse sicher nachzuweisen.
Fazit: Digitalisierung als Compliance-Booster
Die steigende Zahl an FDA Warning Letters verdeutlicht den Handlungsbedarf in der pharmazeutischen und medizintechnischen Industrie. Eine gezielte Digitalisierung durch MES und LIMS kann nicht nur Compliance-Risiken reduzieren, sondern auch die Effizienz der Prozesse erhöhen. Unternehmen, die in moderne Systeme investieren, können langfristig nicht nur regulatorische Anforderungen erfüllen, sondern auch Wettbewerbsvorteile sichern.
Jetzt handeln: Wer in MES und LIMS investiert, kann FDA Warning Letters vermeiden und die Zukunft der Produktion und Qualitätskontrolle aktiv gestalten.
Autoren
Sie möchten mehr über dieses Thema erfahren oder individuelle Herausforderungen diskutieren?
Unsere Ansprechpartnerinnen und Ansprechpartner stehen Ihnen gerne für ein persönliches Gespräch zur Verfügung.


